Периодический закон – одна из основных основ химии. Он помогает нам понять устройство и свойства химических элементов. Этот закон был открыт и развит российским химиком Дмитрием Ивановичем Менделеевым, который внес огромный вклад в развитие науки. Его периодическая система химических элементов является основой химической науки и применяется во многих областях жизни.
Периодическая система Менделеева включает в себя все известные химические элементы, располагая их в определенном порядке. Элементы распределены по возрастанию атомных номеров и упорядочены по возрастанию массы атомов. Это помогает нам легко находить информацию о каждом элементе и использовать их в различных химических реакциях и процессах.
Менделеев разбил химические элементы на группы и периоды, основываясь на их свойствах и химической активности. Кроме того, он предсказал существование некоторых элементов, которые были открыты лишь много лет спустя. Сегодня периодическая система Менделеева является основой для изучения химии в школе и дает нам возможность лучше понять мир вокруг нас и механизмы взаимодействия элементов.
Изучение периодического закона и периодической системы Менделеева является неотъемлемой частью обучения химии в 9 классе. Надеюсь, что эта статья поможет вам лучше понять и усвоить эту тему и продвинуться в изучении химии.
Что такое периодический закон?
Периодический закон был открыт русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Он предложил систематизировать известные на тот момент элементы и создал периодическую систему химических элементов, которая стала основой для современной периодической системы.
Основная идея периодического закона заключается в том, что химические свойства элементов периодически повторяются, то есть имеют аналогичные свойства через определенные промежутки. Каждый новый период начинается с элемента, обладающего типичными свойствами для этого периода, а каждая новая группа (столбец) соответствует определенному типу химических соединений.
Периодический закон позволяет предсказывать свойства новых элементов и находить взаимосвязи между элементами. Он является фундаментальной основой в изучении химии и играет важную роль в разных областях науки и техники.
Определение и основные принципы
Основными принципами периодического закона являются следующие:
| Принцип | Описание |
|---|---|
| Периодичность | Химические свойства элементов повторяются через определенные промежутки элементов в периодической системе. |
| Постепенное увеличение атомных масс | Атомные массы элементов увеличиваются по мере движения слева направо и сверху вниз по периоду. |
| Группировка элементов | Элементы, имеющие сходные химические свойства, располагаются в вертикальных группах. |
| Расположение элементов в порядке возрастания атомных номеров | Элементы располагаются в периодической системе по возрастанию атомных номеров, что соответствует увеличению количества протонов в ядре атома. |
Благодаря периодическому закону и периодической системе Менделеева ученые смогли лучше понять и систематизировать свойства химических элементов, а также предсказывать свойства еще неизвестных элементов.
История открытия и развитие концепции
Идея периодического закона и периодической системы химических элементов возникла через несколько веков после начала научных исследований в химии. Исследователи обнаружили, что множество химических элементов можно классифицировать и организовать в систему.
Первый шаг в этом направлении был сделан Йоганнесом Доберейнером в начале XIX века. Он разработал известный как ‘Закон трех периодов’, который позволял устанавливать связь между определенными группами элементов и их свойствами. Этот закон имел свои ограничения и не обеспечивал полной классификации всех элементов.
В конце XIX века Дмитрий Иванович Менделеев разработал периодическую систему химических элементов. Он исследовал и классифицировал элементы с учетом их атомных масс, химических свойств и реактивности. Менделеев упорядочил элементы в таблицу, ставших основой современной периодической системы. Он также использовал свою таблицу, чтобы предсказать существование и свойства неизвестных тогда элементов.
С течением времени периодическая система Д. И. Менделеева была усовершенствована другими учеными. Новые элементы были открыты, и они нашли свое место в таблице. Система также была расширена, чтобы включить более подробную информацию о каждом элементе, такую как атомную структуру и химические свойства.
Сегодня периодическая система является одним из самых важных инструментов в химии и науке в целом. Она помогает ученым классифицировать и изучать свойства химических элементов, а также предсказывать их химическую реактивность. Развитие концепции периодического закона и периодической системы продолжается до сих пор, с учетом новых открытий и теоретических моделей.
Периодическая система химических элементов
Основной принцип периодической системы — это закономерное повторение свойств элементов с определенным периодичностью. Элементы, расположенные в одной периоде, имеют одинаковое количество электронных оболочек. А элементы, находящиеся в одной группе, имеют одинаковое количество валентных электронов и сходные свойства.
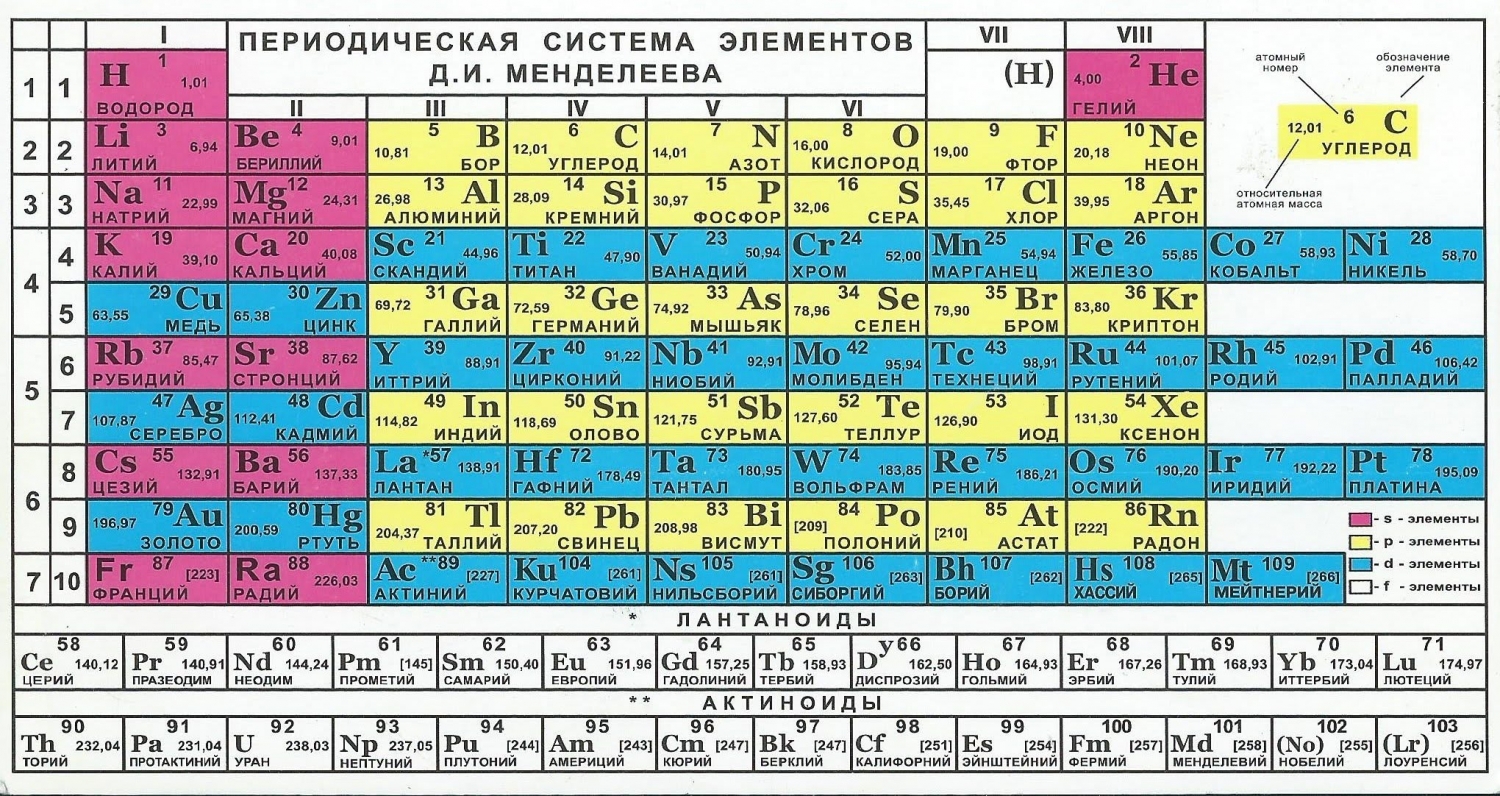
Периодическая система химических элементов состоит из 7 периодов и 18 групп. Главные группы обозначаются арабскими цифрами, а побочные (переходные) группы — латинскими буквами. Нумерация периодов начинается с первого периода, который состоит из двух элементов — водорода и гелия.
Каждый элемент периодической системы характеризуется своим атомным номером, знаком химического элемента и атомной массой. В таблице также указаны другие важные характеристики элементов, такие как количество электронов в атоме, тип химического элемента и его внешняя электронная конфигурация.
Структура и устройство таблицы Менделеева
В таблице Менделеева элементы располагаются в порядке возрастания атомного номера. Каждый элемент представлен клеткой, в которой указаны его химический символ, атомный номер и относительная атомная масса. Клетки группируются в ряды и столбцы согласно определенным правилам.
Строки таблицы Менделеева называются периодами и обозначают номер энергетического уровня, на котором находятся электроны атомов элементов данного периода. Всего в таблице Менделеева существует 7 периодов.
Столбцы таблицы Менделеева называются группами и определяют химические свойства элементов. В таблице Менделеева принято выделять 18 групп, от I до VIII, а также 3 дополнительные группы: восходящих лантаноидов, восходящих актиноидов и металлических неметаллов.
Одна из ключевых особенностей таблицы Менделеева — наличие периодического закона, который устанавливает связь между строением атомов и их свойствами. Согласно этому закону, свойства элементов повторяются периодически с изменением атомного номера. Это способствует систематическому изучению и классификации элементов в таблице.
Таким образом, структура и устройство таблицы Менделеева позволяют ученым исследовать и классифицировать химические элементы, а также отображать их свойства и взаимосвязи. Это ключевой инструмент в изучении химии, который помогает наглядно представить информацию о многообразии и закономерностях в мире химических элементов.
Значение и применение периодической системы
Периодическая система имеет огромное значение для науки и техники. Она является основой для понимания принципов строения и свойств всех химических элементов. Благодаря этому, научные исследования и технологические разработки в различных областях становятся более эффективными.
Периодическая система позволяет предсказывать свойства и взаимодействия элементов. Она помогает ученым разрабатывать новые материалы и соединения, находящие применение в разных отраслях промышленности. Например, наличие определенных элементов в материалах может придавать им необходимые физические и химические свойства, что полезно при создании новых легких и прочных материалов для авиационной и космической промышленности.
Кроме того, периодическая система позволяет предсказывать реакцию элементов в химических реакциях и составлять уравнения реакций. Это очень важно для разработки новых методов синтеза химических веществ и различных соединений, которые могут быть применены в медицине, агрохимии, фармакологии и других отраслях науки.
Благодаря периодической системе ученые могут систематизировать и систематически анализировать колоссальное количество данных о химических элементах. Это помогает в дальнейшем развитии химии и расширении наших знаний о микромире веществ и взаимодействиях между ними.
Таким образом, периодическая система является основой современной химии и играет важную роль в науке и технике, открывая перед учеными огромный потенциал для открытий и разработок. Она позволяет систематизировать знания о химических элементах и предсказывать их свойства, что способствует развитию различных отраслей науки и обеспечивает нашу жизнь множеством новых материалов и технологий.
Элементы и их свойства
Элементы в периодической системе химических элементов Д.И. Менделеева представляют собой вещества, состоящие из атомов одного и того же вида. Всего в периодической системе насчитывается 118 элементов. Каждый элемент имеет свою уникальную химическую символику, которая указывается в периодической таблице.
Каждый элемент обладает определенными свойствами, которые определяют его поведение в химических реакциях. Основные свойства элементов включают:
- Атомный номер: это порядковый номер элемента в периодической системе. Он указывает на количество протонов в атоме элемента.
- Атомная масса: это средний вес атома элемента, выраженный в атомных единицах массы (аму).
- Химическая активность: это способность элемента вступать в химические реакции и образовывать соединения с другими элементами.
- Электроотрицательность: это способность атома элемента притягивать к себе электроны во время химических реакций.
- Физические свойства: это свойства элемента, связанные с его физическим состоянием, например, плотность, температура плавления и кипения, твердость и т.д.
Знание свойств элементов позволяет предсказывать и объяснять их поведение в химических реакциях, а также использовать их в различных областях науки и промышленности.
Металлы и их химические свойства
Одно из ключевых химических свойств металлов — активность. Многие металлы реагируют с кислородом, образуя оксиды, которые часто являются основаниями. Например, железо реагирует с кислородом из воздуха, образуя ржавчину. Металлы также могут реагировать с кислотами, образуя соли и выделяя водород.
| Металл | Символ | Атомная масса |
|---|---|---|
| Железо | Fe | 55.85 |
| Алюминий | Al | 26.98 |
| Медь | Cu | 63.55 |
| Свинец | Pb | 207.2 |
Металлы также обладают хорошей термической и электрической проводимостью. Это свойство делает их идеальными материалами для использования в различных приложениях, включая провода, электроды и отопительные элементы.
Еще одно химическое свойство металлов — способность образовывать ионы. За счет своей малой электроотрицательности, металлы легко отдают электроны и образуют положительно заряженные ионы. Например, натрий образует ион Na+, а магний — ион Mg2+.
Металлы имеют широкий спектр применений и являются важными материалами в промышленности, науке и технологии.
Неметаллы и их химические свойства
В периодической системе химических элементов Д.И. Менделеева неметаллы занимают правую часть таблицы. Они обладают рядом характерных свойств, отличающих их от металлов:
- Неметаллы обычно имеют низкую температуру плавления и кипения. Например, самым легким галогеном – фтором – является газ, условиями жизни приближенный к Нат. А простой химическим элемент кислород, существующий воздухе, не смотря на ее важные и сложные функции (существование живых организмов, горение). Железо, которое явлется металлом, уже таящие точки 1538 градусов Цельсия
- Неметаллы обычно не обладают светящимися свойствами. В отличие от металлов, которые могут иметь металлический блеск, неметаллы обычно не отражают света и не обладают металлическим блеском
- Неметаллы обладают переменной электронной проводимостью. Обычно они являются слабыми или непроводящими электричество, однако, некоторые неметаллы, такие как графит, способны проводить электричество в специальных условиях
- Неметаллы характеризуются большой активностью при реакции с металлами, неметаллами и другими веществами. Они часто образуют соли, кислоты и газы, а также принимают активное участие в окислительно-восстановительных реакциях
- Некоторые неметаллы обладают ядовитыми свойствами и могут быть опасными для человека и окружающей среды. Например, хлор и фосфор являются ядовитыми веществами, которые должны быть использованы с осторожностью в промышленности и научных лабораториях
Неметаллы играют важную роль в химической промышленности, медицине, энергетике и других областях. Изучение и понимание их химических свойств является неотъемлемой частью химии и помогает расширить наши знания о мире веществ и их взаимодействии.
Вопрос-ответ:
Что такое периодический закон?
Периодический закон — это закономерность, согласно которой свойства химических элементов регулярно повторяются с изменением их атомных номеров.
Кто разработал периодическую систему химических элементов?
Периодическую систему химических элементов разработал русский химик Дмитрий Иванович Менделеев в 1869 году.
На чем основывается периодический закон?
Периодический закон основывается на постепенном изменении химических свойств элементов с изменением их атомных номеров и строится на основе расположения элементов в периодической системе.
Какая структура имеет периодическая система?
Периодическая система имеет табличную структуру, состоящую из строк (периодов) и столбцов (групп), где каждый элемент расположен в соответствии с его атомным номером и химическими свойствами.
Какие свойства элементов повторяются в периодической системе?
В периодической системе повторяются такие свойства элементов, как атомный радиус, ионный радиус, валентность, электроотрицательность, химическая активность и др.
Какой периодический закон открыл Д.И. Менделеев?
Д.И. Менделеев открыл периодический закон, который утверждает, что свойства химических элементов периодически меняются в зависимости от их атомных масс.
Что такое периодическая система химических элементов?
Периодическая система химических элементов — это упорядоченная таблица, в которой элементы располагаются в порядке возрастания атомных номеров и сгруппированы по сходству своих химических свойств.